Das einzigartige Innere von nuklearen Kondensaten
Neue Studie der Forschungsgruppe Hnisz in Nature
Menschliche Zellen enthalten über 40 verschiedene Arten von proteinhaltigen Tröpfchen – sogenannte biomolekulare Kondensate. Kondensate enthalten ungewöhnlich hohe Mengen an Proteinen und Nukleinsäuren, und es wird seit langem vermutet, dass sich die Umgebung im Inneren von Kondensaten von der übrigen Zelle unterscheidet. Die Überprüfung dieser Hypothese war bislang schwierig, da es keine Werkzeuge gab, um das Innere von Kondensaten in lebenden Zellen zu verändern. In einer groß angelegten Zusammenarbeit hat das Labor von Denes Hnisz ein einzigartiges Werkzeug zur Untersuchung des Inneren von Kondensaten in lebenden Zellen entwickelt und dabei einige überraschende Entdeckungen gemacht.
Proteine in einer Zelle sind nicht zufällig angeordnet, sondern in kleine Organellen unterteilt. Organellen ohne umgebende Membran werden allgemein als biomolekulare Kondensate bezeichnet. Viele Kondensate und die darin konzentrierten Proteine sind an verschiedenen zellulären Prozessen beteiligt. Kondensate haben vermutlich Eigenschaften, beispielsweise Viskosität, die die einzelnen Moleküle für sich genommen nicht besitzen. Bislang war es schwierig, die Zusammenhänge zwischen dem physikalischen Zustand der Biomoleküle in Kondensaten und ihrer Beziehung zu biologischen Funktionen in Zellen zu untersuchen.
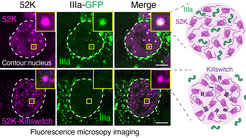
Yaotian Zhang und Henri Niskanen entdeckten gemeinsam im Labor von Denes Hnisz ein kurzes Mikropeptid mit 17 Aminosäuren, das sie „Killswitch“ nannten und zu einem Werkzeug weiterentwickelten, mit dem sich der physikalische Zustand von Biomolekülen in Kondensaten selektiv verändern lässt. Sie knüpften den Killswitch an einen Anti-GFP-Nanokörper und führten ihn in Zellen ein, die verschiedene biomolekulare Kondensate enthielten, die mit grün fluoreszierendem Protein (GFP) markiert waren. Die Wissenschaftler beobachteten ein ungewöhnliches und überraschendes Verhalten der Biomoleküle innerhalb der Kondensate, das in mehreren Fällen ihre Funktion dramatisch beeinträchtigte.
Sie beobachteten, dass Killswitch die GFP-markierten Proteine innerhalb der Kondensate „verklebt“ und die ansonsten dynamischen, flüssigkeitsähnlichen Tröpfchen verfestigte. Der Killswitch hatte die bemerkenswerte Fähigkeit, über ein Dutzend verschiedener Arten von Kondensaten in Zellen zu verfestigen, darunter Nukleoli, Onkoprotein-Kondensate und virale Kondensate. Durch die einfache Einschränkung der Mobilität eines Proteins veränderte der Killswitch das Innere der Kondensate, wodurch die Rekrutierung anderer Proteine in die Kondensate gehemmt wurde.
Bei der Untersuchung der Wirkung des Killswitch auf virale Kondensate stießen die Forscher auf eine weitere Überraschung. Von Adenoviren kodierte virale Proteine bilden ein großes Kondensat, in dem sich infektiöse Viruspartikel ansammeln. Die Forscher fanden heraus, dass der Killswitch verhindern konnte, dass die viralen Proteine in die Kondensate eindringen, sodass keine weiteren infektiösen Viruspartikel mehr produziert wurden.
Denes Hnisz erklärt die größte Überraschung der Studie: „Die verschiedenen viralen Proteine können in Lösung miteinander interagieren, aber sobald wir das Kondensat mit dem Killswitch angreifen, ist dies nicht mehr möglich. Dies ist einer der ersten experimentellen Nachweise dafür, dass dasselbe Protein sich innerhalb eines Kondensats anders verhält als außerhalb.“
Die Ergebnisse der Studie könnten in Zukunft für therapeutische Zwecke genutzt werden. Es ist bekannt, dass in Krebszellen viele verschiedene Kondensate auftreten. Die Wissenschaftler untersuchten krebspezifische Kondensate. „Die Daten unserer Kooperationspartner in Wien zeigten, dass wir die Vermehrung von Krebszellen blockieren, indem wir mit dem Killswitch Kondensate aus nukleären Onkoproteinen verfestigen“, sagte Yaotian Zhang, Doktorand im Hnisz-Labor und Erstautor der Studie.
Bislang kann das Tool noch nicht zur Behandlung von Krebs eingesetzt werden. Weitere Studien sind erforderlich, damit das Mikropeptid spezifisch an die richtige Wirkungsstelle in der Zelle binden kann. Es gibt keine universell einsetzbaren Tools, um alle Arten von Kondensaten in lebenden menschlichen Zellen gezielt zu manipulieren.
„Die Schwierigkeit besteht darin, die Mikropeptide gezielt auf bestimmte Zellen und bestimmte Stellen innerhalb der Zellen auszurichten“, sagt Henri Niskanen, Postdoktorand und korrespondierender Autor der Studie.
Die Wissenschaftler planen daher, weitere Mikropeptide zu entwickeln, die alle Arten von Kondensaten in menschlichen Zellen erkennen und binden können. Außerdem wollen sie testen, wie diese die Funktion der Kondensate beeinflussen.
Die Arbeit wurde von einem interdisziplinären Netzwerk von Wissenschaftler*innen durchgeführt. Neben den Laboren von Tugce Aktas und Matt Kraushar waren auch die Servicegruppen des MPIMG beteiligt: FACS, Mikroskopie, Sequenzierung und Massenspektrometrie. Darüber hinaus waren Wissenschaftler*innen aus mehreren internationalen Instituten beteiligt: die Veterinärmedizinische Universität Wien, das St. Anna Kinderkrebsforschungsinstitut (CCRI), das Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften (CeMM) in Wien, das Hospital of Philadelphia und die Perelman School of Medicine der University of Pennsylvania in den USA sowie die Universität Lausanne in der Schweiz.












