Ribosomen, die Eiweißfabriken der Zelle, lüften ihre Geheimnisse
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für molekulare Genetik
Einleitung
Entwicklung und Unterhalt der Zellprozesse sind im Zellkern in einem umfassenden genetischen Programm, der DNA, festgelegt. Die genetische Information besteht vor allem in der Strukturinformation der Proteine, welche die zellulären Prozesse kontrollieren und ermöglichen. Um das Programm in Zellgeschehen und Entwicklung umzusetzen, werden nach einem festgelegten Regelwerk die genetischen Informationen abgerufen.
Schauen wir uns zunächst die Synthese eines Proteins an: Hierzu wird eine Kopie oder Arbeitspause (mRNA) von der Information des betreffenden Gens hergestellt und zu den Ribosomen, dem Ort der Proteinsynthese, gebracht. Die Ribosomen gliedern sich in eine große und eine kleine Untereinheit, die gemeinsam aus über 50 verschiedenen Komponenten bestehen. Zur Proteinsynthese werden die Bausteine der Proteine, die Aminosäuren, mittels aminoacylierter transfer-RNAs (tRNAs) zu den Ribosomen gebracht.
DNA und RNA bestehen aus langen Ketten mit vier verschiedenen Bausteinen, den Nukleotiden, die sich paarweise nach dem Schlüssel-Schloss-Prinzip aneinanderlagern und eine Doppelhelix bilden. Dabei paaren sich jeweils die Nukleotide A und T sowie G und C, man sagt auch, A und T sowie G und C sind zueinander komplementär. RNA enthält statt T (Thymidin) das Nukleotid U (Uridin). Den vier RNA-Nukleotiden stehen 20 Aminosäuren gegenüber. Ein „RNA-Wort“ aus jeweils drei Nukleotiden (= Codon) legt eindeutig eine bestimmte Aminosäure in der Polypeptid-Kette fest, z.B. AUG die Aminosäure „Met“ (Methionin) oder „fMet“ (Formyl-Methionin) in der Startphase. Dieses System kennt 64 Codons, drei davon sind Stopp-Signale für die Proteinsynthese, die übrigen 61 kodieren Aminosäuren, wobei einer bestimmten Aminosäure von einem bis zu sechs Codons zugewiesen sein können. Der Übersetzungsschritt eines AUG-Codons einer mRNA am Ribosom bedient sich der L-förmigen tRNA, welche die Aminosäure trägt und die komplementäre Sequenz UAC exponiert: Durch die Ausbildung der kurzen, zueinander passenden Tripletts AUG/UAC wird die Met-tRNA erkannt und am Ribosom gebunden.
Drei tRNA Bindestellen am Ribosom: die A-, P- und E-Stelle
Abbildung 1 stellt die wohl einfachste Darstellung der Proteinsynthese dar: Die kleine ribosomale Untereinheit „30S“ erkennt das Startsignal auf einer mRNA mitmilfe einer spezifischen fMet-tRNA, die in die mittlere P-Stelle gebunden wird. Danach wird die große Untereinheit „50S“ aufgenommen und der „70S“ Initiationskomplex fertig gestellt (oben in Abb. 1). In der benachbarten A-Stelle befindet sich dann beispielsweise das mRNA-Codon UUC für die Aminosäure „Phe“. Wie beim Start in der P-Stelle wird jetzt in die A-Stelle die Phe-tRNA ausgewählt und gebunden, weil sie das zum Codon komplementäre AAG-Anticodon trägt.
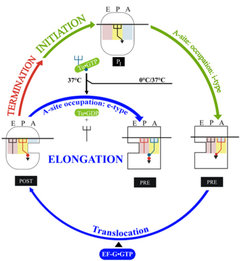
Damit tritt das Ribosom in die wesentliche Phase der Proteinsynthese ein, nämlich die Elongationphase, in der die wachsende Aminosäurekette, das Polypeptid, schrittweise um jeweils eine Aminosäure nach Maßgabe der Codonsequenz auf der mRNA verlängert wird. Dabei ist nicht direkt eine aminoacylierte tRNA (aa-tRNA) das Substrat für die Decodierung in der A-Stelle, vielmehr liegt jede aa-tRNA als Komplex mit dem Elongationsfaktor EF-Tu und GTP vor und wird als aa-tRNA•EF-Tu•GTP-Komplex selektioniert. Nehmen wir wieder an, dem AUG Codon würde ein UUC Codon folgen, welches spezifisch für die Phe-tRNA ist (Phe = Phenylalanin): Nach erfolgreicher Bindung verlässt (EF-Tu•GDP +Pi) das Ribosom und die Phe-tRNA bindet an die A-Stelle. Unser Modell-Ribosom trägt jetzt eine fMet-tRNA in der P- und eine Phe-tRNA in der A-Stelle. Im nächsten Schritt wird der fMet-Rest von der P-Stelle auf die Phe-tRNA in der A-Stelle über eine Peptidbindung übertragen, sodass nun eine tRNA in der P-Stelle und eine fMet-Phe-tRNA in der A-Stelle vorliegt.
Der Elongationszyklus für die Phe-tRNA wird beendet, indem mRNA und beide tRNAs um eine Codon-Länge auf dem Ribosom verschoben werden - eine Aufgabe des zweiten Elongationsfaktors EF-G•GTP. In konzertierter Aktion wandern die tRNAs von der P- in die E-Stelle, die fMet-Phe-tRNA von der A- in die P-Stelle und ein neues Codon in die A-Stelle. Mit der Bindung des dem neuen Codon entsprechenden Komplexes aa-tRNA•EF-Tu•GTP beginnt der nächste Elongationszyklus.
Die Rolle der E-Stelle
Seit Mitte der 60er-Jahre war die Notwendigkeit der A- und P-Stellen klar: Die P-Stelle trägt die Peptidyl-tRNA vor der Bildung der Peptidbindung, die A-Stelle bindet die Aminoacyl-tRNA entsprechend des vorliegenden Codons. Aber was ist die Aufgabe der E-Stelle ? Die E-Stelle wurde erst 1981 gefunden [2], inzwischen ist sie in Ribosomen der Zellen aller Lebensdomänen (Bakterien, Archaea und Eukarya) nachgewiesen worden (Übersicht in [3]). Mindestens zwei wichtige Rollen der E-Stelle können für die präzise Übersetzung der genetischen Information ausgemacht werden:
1) Wenn eine tRNA die E-Stelle besetzt, wird die A-Stelle derart verändert, dass sie im Wesentlichen nur noch die Dekodierung über Codon-Anticodon-Wechselwirkung zulässt, während andere Interaktionen wie EF-Tu mit dem Ribosom vorerst unterdrückt werden. Die Folge ist, dass nur entweder die aa-tRNA mit dem richtigen Anticodon oder, in seltenen Fällen, eine mit ähnlichem Anticodon gewählt werden kann, während aa-tRNAs mit unähnlichen Anticodonen (die überwiegende Mehrzahl) nicht gebunden werden kann. Das Codon-Lexikon ist so organisiert, dass ähnliche Codone auch chemisch ähnliche Aminosäuren kodieren, sodass bei einem Dekodierungsfehler (einer in 3.000 Dekodierungen) statt der richtigen zumindest eine ähnliche Aminosäure eingebaut wird. Der Fehleinbau einer chemisch ähnlichen Aminosäure hat für Faltung, Struktur und Funktion eines Proteins in der Regel keine nachteiligen Folgen. Tatsächlich zerstört nur einer von 400 Fehleinbauten Struktur und/oder Funktion eines Proteins. Falls die E-Stelle aber unbesetzt bliebe, könnten auch unähnliche Aminosäuren eingebaut werden - mit häufig schwerwiegenden Konsequenzen. Somit sorgt eine besetzte E-Stelle dafür, dass ein Fehl-Decodierung normalerwiese kein Problem für das betroffene Protein darstellt [4]. Nach erfolgter Dekodierung verändert sich wieder die A-Stelle derart, dass die aa-tRNA in die A-Stelle klappt und eine Peptidbindung stattfinden kann.
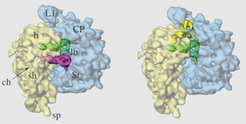
2) Wie in Abbildung 1 zu sehen ist, sind während der Elongationsphase immer zwei tRNAs im Ribosom, entweder in den A- und P-Stellen oder, nach der Verschiebung (Translokation), in P- und E-Stellen. Beide tRNAs sind mit der mRNA mittels Codon-Anticodon-Wechselwirkung verbunden. Diese sechs Basenpaare (drei pro tRNA) verhindern sehr effektiv ein Verrutschen der mRNA, den eine Verschiebung aus dem richtigen Leseraster von 123-123-123 in ein falsches 12-312-312-3 würde zum Verlust der genetischen Information führen [5]. Tatsächlich kann eine vorzeitige Entlassung der tRNA aus der E-Stelle zu einem frühen Abhandenkommen des Leserasters führen und damit Polypeptide mit einer Länge von über 50 Aminosäuren kaum zulassen. In der Regel ist aber ein Protein durchschnittlich 300 bis 500 Aminosäuren lang, was die Bedeutung der E-Stelle für die Lebensvorgänge unterstreicht.
Struktur funktioneller Ribosomenkomplexe
Ein zweiter Schwerpunkt unserer Arbeiten ist die Röntgenstrukturanalyse von Ribosomen zusammen mit verschiedenen Komponenten, die im Laufe der Proteinsynthese an das Ribosom binden. Darüber hinaus widmen sich einige Projekte den Wechselwirkungen des Translationsapparates mit seinem primären Produkt, der wachsenden Polypeptidkette, mit dem Ziel, direkt die de novo-Faltung des translatierten Proteins zu verfolgen und aufzuklären. Von den drei sich ergänzenden Strukturmethoden, die für die Untersuchung des Ribosoms angewendet werden, Kernspinresonanz (NMR), Kryo-Elektronenmikroskopie (Kryo-EM) und Röntgenstrukturanalyse, ist letztere die geeignetste, da sie atomare Details der Wechselwirkungen zwischen Ribosomen und ihren Liganden offenbaren kann (Abb. 2).
Folgende Ribosomenkristalle werden routinemäßig untersucht: 70S-Ribosomen und ihre 30S- und 50S-Untereinheiten des Bakteriums Thermus thermophilus sowie 50S-Untereinheiten der Bakterien Deinococcus radiodurans, Bacillus stearothermophilus und des Archaebakteriums Haloarcula marismortui. Wegen der enormen Größe der Ribosomen (um 3 Mda [Megadalton]) und der wenigen Ribosomen-Kontakte im Kristallgitter existieren große Zwischenräume, in die kleinere Liganden eindringen und ihre Bindestelle am Ribosom finden können. Auf diese Weise wurden in den letzten Jahren Ort und Art wichtiger Antibiotika aufgeklärt. Aber nicht nur Antibiotika (im Bereich von 1 kDa), sondern auch größere Liganden im Bereich von 10 kDa konnten in Ribosomenkristallen untersucht werden. Dabei konnte eine Auflösung von 2,8 Å für die 50S-Untereinheiten von Deinococcus radiodurans-Ribosomen erreicht werden - ein Rekord für bakterielle Ribosomen, der eine detailliertere Untersuchung als bislang möglich erlaubt und zu zahlreichen Berichtigungen der bisherigen Ergebnisse über Antibiotika-Bindestellen führte [7].
Weiterhin wurden Ribosomenkristalle untersucht, um Bindungsort und Mechanismus verschiedener Proteinfaktoren aufzuklären. Beispiele sind der Triggerfaktor (TF), der an das Ribosom bindet und die ko-translationale Faltung der wachsenden Polypeptidkette unterstützt [8], sowie der „Ribosomen Recycling Factor“ (RRF), der nach der Proteinsynthese in Bakterien die Dissoziation des 70S-Ribosoms in seine Untereinheiten betreibt und die kleine 30S-Untereinheit wieder für eine neue Runde der Proteinsynthese bereitstellt [9]. Die letzte Untersuchung hat zu einem Patentantrag geführt, da dieser Faktor nur in Bakterien vorkommt und deshalb Ziel einer neuen Gruppe von Antibiotika sein kann.
Die Röntgenstrukturanalysen werden mit Kryo-EM und Massenspektroskopie-Studien ergänzt. Kryo-EM-Studien werden zusammen mit den Gruppen von R. Agrawal (Albany, USA) und C. M. T. Spahn (Berlin) durchgeführt. Beispiele sind der Faktor ERA, eine GTPase, die am Aufbau der kleinen Untereinheit mitwirkt [10], und ein 70S-Komplex mit dem Elongationsfaktor EF-G, der mit einer für Kryo-EM-Untersuchungen bemerkenswerten Auflösung von 7-8 Å untersucht wurde. Ferner wurden Dynamik und Komposition des universellen L7/L12 Arms der großen Untereinheit untersucht, welcher eine zentrale Rolle bei der Bindung der Elongationsfaktoren spielt. Der überraschendste Befund war, dass statt der üblichen vier Kopien des L7/L12-Proteins in einigen thermophilen Organismen sechs Kopien gefunden wurden, was die Rätsel um Bedeutung und Rolle dieses universellen Strukturmerkmals erheblich vergrößert (zusammen mit C. Robinson, Cambridge [11]). Schließlich wurden mittels NMR und Kryo-EM-Techniken erste Hinweise auf die Beteiligung des Ribosoms bei der unmittelbaren Proteinfaltung gefunden (zusammen mit C. Dobson, Cambridge [12]).
Die großen Fortschritte, die in den letzten Jahren unsere Kenntnisse über Struktur und Funktion der Ribosomen vermehrt haben, lassen hoffen, dass wir in der nächsten Dekade wesentliche molekulare Mechanismen der Proteinsynthese aus der ribosomalen Struktur ableiten können.
![Schema der Proteinsynthese. Während der Initiationsphase bindet die fMet-tRNA, eine spezielle Starter-tRNA (Dreizinken-Gabel), in die P-Stelle. Mit der Decodierung (Übersetzung) des A-Stellen Codons in der A-Stelle betritt das Ribosom die Elongationsphase, in der immer zumindest zwei tRNAs vorliegen, die über Codon-Anticodon Wechselwirkung die mRNA fixieren. PRE, Zustand vor der Translokation der tRNAs; POST, Zustand nach der Translokation (vgl. [1]). Schema der Proteinsynthese. Während der Initiationsphase bindet die fMet-tRNA, eine spezielle Starter-tRNA (Dreizinken-Gabel), in die P-Stelle. Mit de](https://www.mpg.de/389580/zoom-1293749774.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6Mzg5NTgwfQ%3D%3D--24acf1cc7e3665d8202aaff2899eff94b4c09856)
![tRNA-Lagen innerhalb eines Ribosoms in den beiden wichtigsten Komplexen während einer Elongationsphase: Kryo-elektronenmikroskopische Rekonstruktion von tRNAs im PRE- und POST-Stadium, die an ein 70S-Ribosom gebunden sind (mRNA nicht dargestellt). PRE: tRNAs sind an die A- (rosa-violett) und P-Stellen (grün) des Ribosoms gebunden. Bei der Translokation wandern sie von der A- in die P- und von der P- in die E-Stelle (POST) (modifiziert nach [6]). tRNA-Lagen innerhalb eines Ribosoms in den beiden wichtigsten Komplexen während einer Elongationsphase: Kryo-elektronenmikroskopische Rekonstruktion v](https://www.mpg.de/389636/zoom-1293750124.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6Mzg5NjM2fQ%3D%3D--41c952503e55fdd662d93cfa2b30e320e72975b1)