Protein-Monoaminylierung: Neu erkannte Funktionen monoaminerger Hormone
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für molekulare Genetik
Genomforschung und Physiologie gehen Hand in Hand
Die monoaminergen Neurotransmitter Serotonin (5-HT), Histamin (HA), Dopamin (DA) und Norepinephrin (NE) sind biogene, primäre Amine, die in der Tierwelt potente hormonelle Wirkungen ausüben. Neben ihrer komplexen Rolle als Neurotransmitter im Nervensystem ko-regulieren diese niedermolekularen Substanzen alle denkbaren Lebensprozesse – bereits an der Reifung von Eizellen in Säugetieren sind die Catecholamine DA und NE beteiligt [1]. Seit den frühen 1950er-Jahren ist außerdem bekannt, dass 5-HT und Catecholamine sowohl die präneuronale Embryonalentwicklung als auch die Fötalentwicklung steuern [2].
Auf die Frage, weshalb dieser physiologischen Thematik ausgerechnet am Max-Planck-Institut für molekulare Genetik in der Abteilung für Humangenetik nachgegangen wird, gibt es eine einfache Antwort: Nach der Entschlüsselung des humanen Genoms, an der das Institut mitbeteiligt war, stellt sich jetzt vermehrt die Frage, was es aus der Flut an Daten der „nackten“ Gensequenzen zu lernen gilt. Die vielleicht wichtigste Erkenntnis aus diesen Daten ist, dass unser menschliches Genom nur vergleichsweise wenige Gene mehr aufweist als das Genom der Fruchtfliege (Drosophila melanogaster) oder des Fadenwurms (Caenorhabditis elegans). Menschen unterscheiden sich also nicht wesentlich in der Zahl, sondern eher in der Funktionsweise der Gene und Genprodukte von denjenigen Organismen, die wir als „simpler“ als uns selbst betrachten. Es ist daher unabdingbar geworden, weniger die DNA-Sequenzen, als vielmehr die Funktionen von Genen im Vergleich mit anderen Spezies zu untersuchen, um die Unterschiede besonders zwischen höheren Lebewesen zu verstehen. Ein erheblicher Teil des Max-Planck-Instituts ist mit diesen Arbeiten ausgelastet, und so lässt sich auch verstehen, dass die Genetik inzwischen interdisziplinär von einer breiten Sammlung von Spezialisten unterschiedlicher Fachrichtungen bearbeitet wird. Mediziner, Bioinformatiker, Genetiker, Biochemiker, Chemiker, Biologen und Ingenieure finden eine gemeinsame Sprache für das gemeinsame Ziel, die Grundlagen des Lebens durch vergleichende Genomforschung und physiologische Untersuchungen zu verstehen und Bekanntes mit Neuem in zukunftsweisenden Hypothesen zu vereinen.
Von Gendefekten kranker Menschen zur Physiologie
In der Abteilung für Molekulare Humangenetik sind in den vergangenen Jahren etwa 60 menschliche Gene identifiziert worden, deren Störung durch Mutationen oder chromosomale Aberrationen geistige Behinderung und Fehlentwicklungen des menschlichen Gehirns verursacht. Durch genomische Vergleiche mit einfachen Modellorganismen wie D. melanogaster und C. elegans konnte einigen dieser Gene eine physiologische Rolle, beispielsweise als Transkriptionsfaktor, zugeschrieben werden. Weil im evolutiven Stammbaum die Komplexität der Funktionsweise von Genen zunimmt, sind solche Erkenntnisse aber keineswegs eins zu eins übertragbar, außer wenn es sich um grundlegende Mechanismen handelt. Säuger wie Maus, Ratte und Primaten haben sich in der vergleichenden Genetik und Physiologie seit Jahrzehnten als Modellorganismen etabliert, obwohl auch hier die evolutionäre Distanz von mehreren Millionen Jahren nicht außer Acht bleiben kann (ca. 60 Millionen Jahre zwischen Mensch und Nagern und ca. 6 Millionen Jahre zwischen Mensch und seinem nächsten Verwandten, dem Schimpansen Pan troglodytes).
Experimentell hat sich aber insbesondere die Maus wegen ihrer kurzen Generationszeit und wegen der verhältnismäßig einfachen Manipulierbarkeit ihres Genoms als beliebtes Säugetiermodell durchgesetzt. Unbestreitbar grundlegende Unterschiede zwischen Mensch und Maus verbleiben jedoch immer. Bei vergleichbaren Eigenschaften von Krankheiten zwischen Menschen mit spezifischen Genschäden und Mäusen mit gezielt nachvollzogenen Veränderungen ihrer Gene sind letztere, nämlich die genmanipulierten Mäuse, jedoch der Schlüssel für ein tief greifendes Verständnis der zugrunde liegenden physiologischen Zusammenhänge, die eine Krankheit ausmachen.
Aus diesen Gründen sind in den vergangenen Jahren zahlreiche Tiermodelle in der Abteilung für Humangenetik etabliert worden, deren Untersuchung bereits Früchte getragen hat. Weitere Tiermodelle werden zurzeit intensiv interdisziplinär bearbeitet. Eine wichtige Erkenntnis dieser Arbeiten ist, dass fast alle bisher untersuchten Gendefekte nicht nur die Entwicklung und Funktion des Gehirns beeinflussen, sondern auch in anderen Organen schwer wiegende Veränderungen verursachen, die klinisch zunächst nicht in Zusammenhang mit dem Gendefekt gebracht werden konnten. So war es beispielsweise überraschend, welch signifikante Rolle dem Hormon 5-HT in so verschiedenartigen Prozessen wie der Leberregeneration [3], Blutungsstillung [4], der Entwicklung der Brustdrüse [5] oder der Entstehung von pulmonalem Bluthochdruck [6, 7] zukommt.
Von der Physiologie zu Genuntersuchungen und zurück
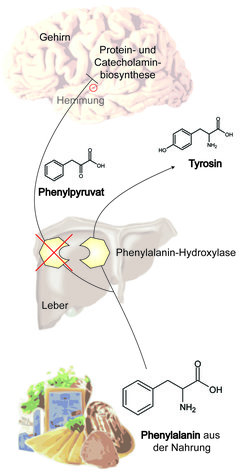
Schon länger ist klar, dass Gene, die einen maßgeblichen Einfluss auf die Entwicklung und Funktion des Gehirns haben, keinesfalls zwingend im Gehirn selbst exprimiert sein müssen. Das vielleicht treffendste Beispiel hierfür ist die Phenylketonurie, die unbehandelt unter anderem zu schwerer geistiger Behinderung führt. Die Entdeckung des im Urin von Patienten stark angereicherten Phenylpyruvats durch den Physiologen Asbjörn Fölling im Jahre 1934 führte in den darauf folgenden Jahrzehnten zur Aufklärung des zugrunde liegenden Gendefekts: Mutationen des Phenylalanin-Hydroxylase-Gens. Das Enzym wird prädominant in der Leber exprimiert, liegt es jedoch in defekter Form vor, so entstehen toxische Stoffwechselprodukte, die große Schäden im Gehirn mit der Folge einer geistigen Behinderung verursachen (Abb. 1).
Nicht immer können physiologische Befunde so eindeutig auf ein einzelnes defektes Gen zurück geführt werden. Meist lassen sich jedoch von derartigen physiologischen Ausgangspunkten Kandidatengene eingrenzen, die dann im Einzelnen näher betrachtet werden können. Auch hier sind genmanipulierte Mäuse eines der wichtigsten Instrumente zur Untersuchung eines Kandidatengens im physiologischen Kontext.
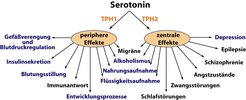
Ein Beispiel aus den letzten Jahren ist die Tryptophan-Hydroxylase (TPH). Dieses Enzym ist geschwindigkeitsbestimmend in der Biosynthese von 5-HT (Serotonin). Seit Jahrzehnten wird die Beteiligung von 5-HT an psychiatrischen Erkrankungen mit TPH als Kandidatengen untersucht. Deshalb wurden TPH-defiziente Tiere generiert, die nachfolgend ein überraschend neues Licht auf das gesamte serotonerge System werfen konnten: Diese Tiere wiesen unveränderte 5-HT-Gehalte im Gehirn, jedoch kein 5-HT in extraneuronalen Geweben auf [8]. Schnell wurde klar, dass dies nur auf die Existenz eines zweiten TPH-Gens zurückgeführt werden konnte, welches dank dieser Mäuse dann auch im Menschen identifiziert wurde [8, 9]. Interessanterweise wird das altbekannte Gen (TPH1) vor allem in extraneuronalen Geweben exprimiert, das neu entdeckte Gen (TPH2) jedoch überwiegend in serotonergen Neuronen. Damit bestand Klarheit, dass in der psychiatrischen Forschung über Jahrzehnte hinweg primär ein Gen untersucht worden war, das gar nicht an der zentralnervösen 5-HT-Synthese beteiligt ist (Abb. 2). Es ist jedoch noch nicht auszuschließen, dass sich die beiden serotonergen Systeme gegenseitig beeinflussen. Allerdings ist bereits kurz nach der Entdeckung von TPH2 von zahlreichen Gruppen weltweit eine Assoziation von Polymorphismen dieses Gens mit psychiatrischen Erkrankungen gefunden worden [10], was gegen eine direkte Wechselwirkung der beiden Systeme spricht. Diese Erkenntnisse führen nunmehr zu präzisen diagnostischen Möglichkeiten und dürften daher auch zukünftige therapeutische Ansätze maßgeblich beeinflussen. Und dieses Beispiel belegt auch, weshalb Mäuse in der biomedizinischen Forschung nicht wegzudenken sind.
TPH1-defiziente Tiere offenbaren einen neuen postranslationalen Protein-Regulationsmechanismus
Obwohl TPH1-defiziente Tiere neurochemisch gesehen intakt sind, lässt sich mit ihnen vorzüglich untersuchen, wie sich die Abwesenheit des Hormons 5-HT in peripheren Geweben auswirkt. Dank der aufgefundenen Dualität des serotonergen Systems, einzigartig für die Biosynthese monoaminerger Botenstoffe, sind die Tiere gut lebensfähig, weisen aber ein ganzes Spektrum an interessanten physiologischen Veränderungen auf, die auf die Ursachen menschlicher Erkrankungen übertragbar sind. Der Kenntnisfortschritt der bereits oben genannten Rolle von 5-HT in unterschiedlichen Geweben [3-7] erlaubt es, neue therapeutische Strategien zu entwickeln. Beispielsweise kann von einer Senkung der 5-HT-Spiegel im Blut eine protektive Wirkung auf das Herz-Kreislauf-System erwartet werden, weil die 5-HT-defizienten Tiere ein vermindertes Risiko induzierbaren, pulmonalen Bluthochdrucks sowie ein vermindertes Thrombose- und Thromboembolismusrisiko aufweisen [4, 6]. Unter bestimmten Voraussetzungen dürfte eine Anhebung pathologisch erniedrigter 5-HT-Spiegel im Blut ebenfalls hilfreich sein. Beispielsweise sind die 5-HT-Spiegel im Blut von Alkoholikern stark erniedrigt und Leberschäden gehören sicherlich zu der Hauptfolge chronischen Alkoholmissbrauchs. Die Entdeckung, dass die Leberregeneration in den 5-HT-defizienten Tieren stark beeinträchtigt, aber durch Erhöhung des 5-HT-Spiegels wiederherstellbar ist [3], könnte deshalb von großer Bedeutung in der Vermeidung von Leberschäden bei Alkoholikern sein.
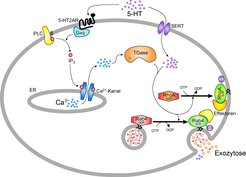
Neben diesen biomedizinischen Zusammenhängen ermöglichte die funktionale Aufklärung der Wirkungsweise von 5-HT in Thrombozyten dank dieser Versuchstiere eine weitere, noch überraschendere Entdeckung: die „Serotonylierung“ von Signalproteinen, die zu deren konstitutiver Aktivierung innerhalb der intrazellulären Signalkaskade führt (Abb. 3) [4]. Dabei handelt es sich um eine postranslationale, kovalente Modifikation der Signalproteine durch 5-HT, ähnlich der Protein-Phosphorylierung. Weil auch die anderen primären, monoaminergen Hormone, HA, DA und NE eine analoge Reaktion eingehen können, wurde dafür der Oberbegriff „Monoaminylierung“ geprägt [4]. Inzwischen liegen Ergebnisse vor, die zeigen, dass nicht nur Signalproteine, sondern auch eine größere Anzahl von Strukturproteinen und Transkriptionsfaktoren monoaminyliert werden – auch deren Eigenschaften werden durch diese Modifikation reguliert. Es bleibt mit Spannung zu erwarten, welche weiteren intrazellulären Prozesse auf diese Weise einer Steuerung unterliegen. Gewiss ist jedoch, dass nun, da die Existenz der Protein-Monoaminylierung bekannt ist, die Erforschung dieser postranskriptionellen Regulation sehr rasch an Bedeutung gewinnt [4, 7].
Schlussfolgerungen
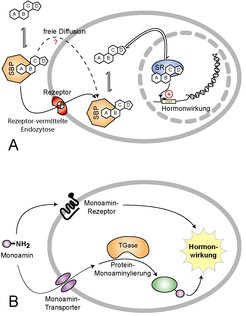
Für das breite Spektrum an hormonellen Wirkungen von Monoaminen wurden stets die zahlreich vorhandenen Membranrezeptoren für diese wasserlöslichen Substanzen verantwortlich gemacht. Allerdings muss unser Lehrbuchwissen über Hormonwirkungen deutlich ergänzt werden, einer Art Paradigmenwechsel nahe kommend: Ursprünglich wurde angenommen, dass fettlösliche Hormone frei durch die Plasmamembran von Zellen diffundieren, um intrazelluläre Rezeptoren zu erreichen, während wasserlösliche Hormone nur extrazellulär über Membranrezeptoren wirken können. Diese Auschließlichkeit erscheint immer weniger haltbar. Eine unbestreitbare Beteiligung von Membranrezeptoren für die spezifische zelluläre Aufnahme fettlöslicher Steroid-Hormone fand beispielsweise eine große Beachtung (Abb. 4 A) [11, 12]. Unsere Erkenntnisse über die Serotonylierung von Proteinen innerhalb der Zelle durch Serotonin decken einen völlig neuen Signalweg für dieses Hormon auf (Abb. 4 B).
Die intrazelluläre Wirkung wasserlöslicher Hormone, nämlich die Monoaminylierung von Proteinen, wird zur Zeit intensiv erforscht [4, 7] und lässt eine Fülle an überraschenden physiologischen Zusammenhängen erwarten. Zurzeit bleibt festzuhalten, dass unser Lehrbuchwissen hormoneller Regulation vermutlich einer straffen Überarbeitung bedarf.

![Die Dualität des serotonergen Systems. Serotonin wird im Gehirn und in extraneuronalen Geweben durch zwei unterschiedliche Tryptophan-Hydroxylasen (TPHs) synthetisiert. Zentralnervöse serotonerge Störungen und Polymorphismen im TPH2-Gen sind an mannigfaltigen psychiatrischen Erkrankungen beteiligt. Peripheres Serotonin besitzt potente hormonelle Wirkungen u.a. im Herz-Kreislauf- und dem Immunsystem. Einige metabolische Funktionen werden von beiden Systemen, aber unabhängig voneinander reguliert. Auch an der Entstehung von Migräne sind beide Systeme beteiligt. Die Gebiete, die in den vergangenen Jahren am Max-Planck-Institut bearbeitet wurden, sind blau hervorgehoben (modifiziert nach [9]). Die Dualität des serotonergen Systems. Serotonin wird im Gehirn und in extraneuronalen Geweben durch zwei unterschiedliche Tryptophan-Hydroxylasen (TP](https://www.mpg.de/463718/original-1293750363.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDYzNzE4fQ%3D%3D--9f14e2558e5659ba198ddd6d0934a2abe354cf50)
![Serotonylierung im Verlauf der Blutungsstillung. 5-HT wird in verletzten Blutgefäßen von Thrombozyten selbst ausgeschüttet und von weiteren Thrombozyten über den 5-HT-Transporter (SERT) in das Cytosol transportiert. Über den 5-HT2A-Rezeptor werden parallel intrazellulär Calcium-Ionen mobilisiert, die, neben anderen Proteinen, Transglutaminasen (TGasen) aktivieren. TGasen verknüpfen 5-HT kovalent mit Signalproteinen in einer Reaktion, die als Serotonylierung bezeichnet wird. Diese posttranslationale Modifikation hat eine konstitutive Aktivierung der Signalproteine zur Folge. Über diesen Mechanismus werden dann sehr rasch Blutgerinnungsfaktoren aus den Thrombozyten freigesetzt, die die Blutungsstillung bewirken (modifiziert nach [4]). Serotonylierung im Verlauf der Blutungsstillung. 5-HT wird in verletzten Blutgefäßen von Thrombozyten selbst ausgeschüttet und von weiteren Thrombozyt](https://www.mpg.de/463774/original-1293749370.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDYzNzc0fQ%3D%3D--0ab1af3e2c5a469e9f687e5a3c9a100cb0459c00)
