Regulatorische Netzwerke bei der Bildung des Rumpfes in Säugetieren
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für molekulare Genetik
Einführung
Die Entwicklung eines Embryos beginnt mit der Verschmelzung von Eizelle und Spermium. Der einzellige Embryo fängt an, sich zu teilen und bildet einen Zellhaufen. Damit jedoch ein überlebensfähiger Organismus heranwachsen kann, müssen sich die Zellen in unterschiedlicher Weise weiterentwickeln und innerhalb des entstehenden Körpers organisieren. Dies basiert auf einer Vielzahl komplexer Prozesse, die einem räumlich und zeitlich streng kontrollierten Ablauf folgen.
Ein wichtiger Grundprozess der Gestaltbildung und Organogenese ist die epithelial-mesenchymale Transition (EMT), die auch bei der Bildung des mittleren Keimblatts (Mesoderm) im Säugetierkeim zum Tragen kommt. Dieser Begriff bezeichnet die Umgestaltung einer polaren, sich im festen Zellverband befindlichen Zelle in eine migrierende, nur lockere Zellkontakte ausbildende Zelle (Abb. 1). EMT kommt nicht nur bei der Mesodermbildung, der Organogenese und vielen Prozessen der Embryonalentwicklung vor, bei denen Zellwanderung eine Rolle spielt, sondern auch bei der Tumorprogression, die zur Metastasenbildung führen kann.
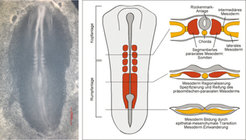
Das Interesse der Abteilung Entwicklungsgenetik am Max-Planck-Institut für molekulare Genetik gilt der Regulation der frühen Ereignisse bei der Rumpfbildung und deren Ähnlichkeit bei der Tumorprogression. Der Schwerpunkt der Arbeit liegt derzeit auf der Entzifferung regulatorischer Netzwerke, die die Bildung und Segmentierung des paraxialen Mesoderms im Embryo kontrollieren.
Regulatorproteine
Im Laufe der vergangenen eineinhalb Jahrzehnte wurden eine Reihe von Regulatorproteinen entdeckt, die eine essenzielle Rolle bei der Bildung des Rumpfes spielen. In mehreren Fällen wurde gezeigt, dass der Verlust des jeweiligen Regulators entweder zum Abbruch der Rumpfbildung führt, was den Tod des Embryos zur Folge hat, oder zu Fehlbildungen zum Beispiel der Wirbelsäule, der Muskulatur oder anderen pathologischen Veränderungen. Mithilfe solcher Zusammenhänge zwischen Genprodukt und Genwirkung auf Teilprozesse der Rumpfbildung konnten einige Gene wichtigen Abläufen der Rumpfbildung zugeordnet werden (Abb. 2).
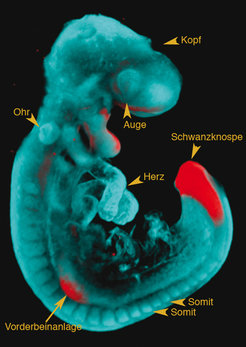
Die Darstellung solcher Zusammenhänge ist aber nur beschreibender Natur, das heißt, ein Genverlust wird mit einer morphologischen Veränderung in Zusammenhang gebracht, ohne dass man versteht, was genau im Inneren der Zelle und zwischen Zellen im Verband auf molekularer Ebene geschieht. Zelluläre Mechanismen innerhalb einer einzigen Zelle und zwischen vielen benachbarten Zellen beruhen auf komplexen Netzwerken tausender interagierender Proteine, deren Herstellung und Funktion streng kontrolliert wird. Fehler in solchen komplexen Regelnetzwerken können zwar teilweise aufgefangen werden, aber auch zu Fehlfunktionen führen. Während der Embryonalentwicklung kann dies, wie schon erwähnt, beispielsweise eine Fehlbildung, im adulten Organismus eine bestimmte Krankheit oder Krebs zur Folge haben.
Wie kann man zu einem tieferen Verständnis der zellulären Prozesse bei der Embryonalentwicklung oder auch im adulten Organismus gelangen? Dazu ist es notwendig, von der Funktionsanalyse einzelner Gene zu einer höheren, viel komplexeren Ebene der Genomanalyse vorzudringen, bei der das Verhalten des gesamten Genoms und der sich davon ableitenden Genprodukte gleichzeitig untersucht werden müssen. Diese neue Analyseform komplexer Vorgänge im lebenden Organismus wird als systembiologischer Ansatz bezeichnet. Um auf diese Ebene vorzudringen, bedarf es neuartiger Analyseverfahren, die teilweise noch in den Kinderschuhen stecken. Im Folgenden werden einige der Verfahren vorgestellt, die in der Abteilung Entwicklungsgenetik ausgearbeitet und angewendet werden.
Methoden zur Erforschung regulatorischer Netzwerke bei der Embryonalentwicklung
i.) Die Sichtbarmachung der Genaktivität im Embryo
Gene, die maßgeblich an regulatorischen Netzwerken beteiligt sind und wichtige Vorgänge bei der Embryonalentwicklung steuern, können durch verschiedene Ansätze identifiziert werden. Als Hauptansatz der Abteilung Entwicklungsgenetik wurde die Genexpressionsanalyse gewählt. Regulatorische Gene sind sehr oft gewebespezifisch exprimiert, werden also nur in bestimmten Zellgruppen oder Organanlagen aktiv. Diese restriktive Expression ergibt ein spezifisches Muster, das im Experiment durch so genannte Hybridisierung sichtbar gemacht werden kann. Dazu wird die Boten-RNA, die von einem aktivierten Gen abgeschrieben wird, im Embryo markiert (Abb. 3). Durch Expressionsanalyse tausender, idealerweise aller Gene im Genom lässt sich die Anatomie des Embryos auf molekularer Ebene widerspiegeln. So kann die Beteiligung der meisten Gene, die maßgeblich an der Kontrolle der Embryonalentwicklung beteiligt sind, aufgedeckt werden. Aus den Daten können Gengruppen erstellt werden, die an Teilprozessen wie der Organbildung oder der Bildung der Wirbelsäule beteiligt sind und in regulatorische Netzwerke eingeflochten werden. Durch Hochdurchsatzverfahren, die im Labor der Abteilung entwickelt wurden, konnten etwa 8000 Mausgene auf Aktivität im Embryo geprüft werden. Sie stehen jetzt unmittelbar für eine Vielzahl funktioneller Untersuchungen zur Verfügung (siehe unten).
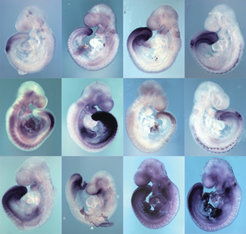
ii.) Ausschalten einzelner Gene durch homologe Rekombination oder RNA-Interferenz
Die Funktion einzelner Gene in biologischen Prozessen kann durch Mutagenese-Verfahren ergründet werden. Dabei wird untersucht, wie sich der Verlust oder die Unterdrückung einer Genfunktion auf den gesamten Organismus auswirken. Das klassische Verfahren, das in 2007 mit dem Nobelpreis ausgezeichnet wurde, verwendet die homologe Rekombination in embryonalen Stammzellen. Dabei wird das gesunde Gen in der Zelle durch ein defektes Gen ausgetauscht, das im Labor angefertigt wurde (so genanntes knock-out Verfahren). Aus den Zellen werden Mäuse hergestellt, die den Gendefekt vererben können. Schließlich untersucht man, welche Wirkung der Verlust des Gens auf den Organismus hat, und leitet daraus die Funktion des Gens ab. Dieses Verfahren ist sehr aufwändig und langwierig.
Ein weiteres Verfahren wurde in Grundzügen beschrieben und wird derzeit für die Verwendung in Mausembryonen optimiert. Es handelt sich dabei um die RNA-Interferenz, deren Entdeckung in 2006 mit dem Nobelpreis ausgezeichnet wurde. Dabei wird die aus einem Gen resultierende Boten-RNA, welche als Matrize zur Herstellung von Proteinen dient, mittels kurzer Gegenstrangsequenzen, die Teilabschnitte auf der Boten-RNA erkennen können, zur Spaltung gebracht und abgebaut oder zumindest an der Verwendung als Matrize gehindert. Dadurch kann gezielt eine ausgewählte Genaktivität stark unterdrückt werden. Dieses Verfahren wird im Zusammenspiel mit einer diffizilen, spezialisierten Technik der Herstellung von Mausembryonen in einer Weise verwendet, die die Untersuchung von Genfunktionen in einem wesentlich kürzeren Zeitraum erlaubt. Damit lassen sich viel mehr Gene in der gleichen Zeit untersuchen, als dies mit der knock-out Methode möglich wäre.
Embryonen, die aufgrund solcher Genmanipulationen Entwicklungsdefekte aufweisen, werden morphologisch und mithilfe von Verfahren, die die Expression von einzelnen Markergenen erkennen lassen (s.o.), auf die Auswirkung des jeweiligen Gendefekts hin untersucht. Darüber hinaus wird ein Verfahren eingesetzt, mit dem die Expression aller Gene im Embryo quantifiziert werden kann, ohne jedoch räumliche Auflösung zu bieten (so genannte Expressionsprofilierung auf Microarrays). Damit lassen sich mit relativ geringem Aufwand diejenigen Gene identifizieren, deren Expression durch den Gendefekt hoch- oder herunterreguliert werden. Durch solche Untersuchungen werden Gene aufgedeckt, die vom untersuchten Regulator direkt oder indirekt abhängig sind.
iii.) Promotoranalysen - in silico, in vitro und in vivo
Jedes Gen besitzt Andockstellen für Regulatorproteine, die kontrollieren, wann und in welchen Zellen das Gen exprimiert wird. Diese Kontrollelemente befinden sich im so genannten Promotor des Gens. Promotoranalysen dienen zur Klärung der Frage, durch welche Regulatorproteine ein bestimmtes Gen in einem bestimmten Zellverband zur Expression gebracht wird. Diese Methodik ist sehr wichtig für die Klärung hierarchischer Beziehungen in Regelnetzwerken (Abb. 4). Regulator/Zielgen-Beziehungen können zwar mit bioinformatischen Werkzeugen untersucht, müssen aber durch aufwändige experimentelle Verfahren validiert werden, da in silico-Vorhersagen noch nicht zuverlässig genug sind, um mit hoher Sicherheit funktionelle Zielsequenzen für Regulatorproteine von zufälligen oder im untersuchten Kontext irrelevanten potenziellen Bindestellen im Promotor eines Gens zu unterscheiden.
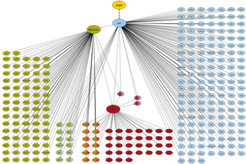
iv.) Genomweite Bindungsstudien von Regulatorproteinen an Zielgene
Einen wichtigen Fortschritt bei der Entdeckung der Zielgene von Transkriptionsregulatoren stellt die Entwicklung der ChIP-Technik (Chromatin Immunpräzipitation) dar, mit deren Hilfe die Bindestellen eines DNA-bindenden Proteins auf den Chromosomen festgestellt werden können. Diese Technik erlaubt es inzwischen, in Verbindung mit neuartigen Hochdurchsatz-Sequenzierverfahren der zweiten Generation genomweite Analysen durchzuführen. Das heißt, dass in einem einzelnen Experiment praktisch jedes Zielgen eines gegebenen Transkriptionsregulators identifiziert werden kann, an das der Regulator zum Zeitpunkt der Entnahme des Gewebes gebunden war (Abb. 5). Allerdings kann aus dem Befund der Bindung eines Regulators an eine Zielsequenz allein noch nicht geschlossen werden, welche Wirkung diese molekulare Interaktion in der Zelle hervorruft. Dazu sind weitere Datensätze notwendig. Diese Neuentwicklung markiert einen Meilenstein in der Bestimmung regulatorischer Netzwerke auf der Ebene der Genkontrolle. Zudem kann diese Methode auch für die genomweite Analyse der epigenetischen Genkontrolle eingesetzt werden.
Molekulare Mechanismen der Bildung und Segmentierung des paraxialen Mesoderms
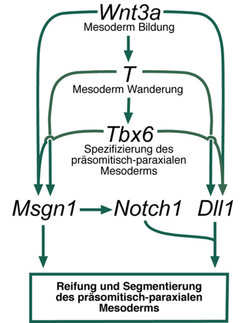
Eine Vielzahl von Analysen hat bisher ergeben, dass die Bildung und Segmentierung des präsomitischen (paraxialen) Mesoderms durch eine Hierarchie von Regulatoren kontrolliert wird, die direkt oder indirekt vom Signalmolekül Wnt3a abhängen [1 – 7]. Wnt3a induziert den Transkriptionsregulator Brachyury (T) sowie den Transkriptionsrepressor Snail1, welche wiederum durch An- beziehungsweise Abschalten ihrer Zielgene die Mesodermbildung einleiten und kontrollieren. Mithilfe von Brachyury wird ein weiterer Regulator, Tbx6, zur Expression gebracht und durch Interaktionen, die noch nicht verstanden sind, in seiner Expression auf präsomitisch-paraxiale Mesodermzellen beschränkt. Wnt3a kontrolliert dann zusammen mit Tbx6 (synergistisch) die Expression von Genen, die die Reifung und Segmentierung des paraxialen Mesoderms zu Somiten, den Vorläufern der Wirbelsäule und Skelettmuskulatur, bewirken. Unter diesen Zielgenen befinden sich unter anderem der Transkriptionsregulator Mesogenin (Msgn1) [7], der die Reifung dieses Zelltyps bewirkt, sowie ein Ligand des Notch-Rezeptors, Delta-like1 (Dll1) [3], der bei der Segmentierung eine wichtige Rolle spielt (Abb. 6).
Diese Hierarchie von Regulatoren bildet das Grundgerüst der Regelnetzwerke bei der paraxialen Mesodermbildung und Segmentierung. Die oben beschriebenen Ansätze dienen dazu, die Zielgene dieser Regulatoren und deren Verknüpfung im Netzwerk zu klären.
Die Segmentierung selbst wird durch einen Oszillator kontrolliert, der ebenfalls wesentlich von Wnt3a gesteuert wird und in rhythmischen Abständen die Abtrennung eines Segmentpaares vom präsomitischen Mesoderm bewirkt. Hierbei interagieren drei Signalkaskaden, die WNT-, FGF- und Notch/Delta-Signalwege, miteinander (Abb. 6) [1, 2]. WNT- und FGF-Signalwege arbeiten parallel (synergistisch), während sich WNT/FGF und Notch antagonistisch verhalten. Jede Signalkaskade generiert mittels negativer Rückkopplung auf Membran-, zytoplasmatischer und Kernebene einen eigenen Oszillator. Allerdings sind diese nicht gleichrangig, da zum Beispiel der Notch-Oszillator nach Abschalten des WNT-Signalwegs ausfällt, während umgekehrt der WNT-Oszillator durch Abschalten des Notch-Signalwegs nicht beeinträchtigt wird. Insgesamt kann man feststellen, dass die Segmentierung und damit die Bildung der Wirbelsäule maßgeblich von der WNT-Signalkaskade gesteuert wird. Weitere Arbeiten zur Aufklärung und Modellierung dieses komplexen Prozesses sind unterwegs.

![9,5 Tage alter Mausembryo nach Sichtbarmachung der Boten-RNA eines Gens, das vor allem in der Schwanzknospe und in Zellen aktiv ist, aus denen die Wirbelsäule und die Skelettmuskulatur entstehen (rot eingefärbt). Die Schwanzknospe am kaudalen (hinteren) Ende des Embryo stellt eine Wachstumszone dar, durch die sequenziell der Rumpf und der Schwanz gebildet werden. Das Bild wurde durch spezielle 3-D- Bildverfahren generiert (optical projection tomography [OPT] mit Volume Rendering). 9,5 Tage alter Mausembryo nach Sichtbarmachung der Boten-RNA eines Gens, das vor allem in der Schwanzknospe und in Zellen aktiv ist, aus denen die Wir](https://www.mpg.de/417794/zoom-1293749323.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDE3Nzk0fQ%3D%3D--77fdf660db6d41b4539ce42e6071f2104d8e9795)



