Edda Schulz erhält renommierte Förderung vom Europäischen Forschungsrat
ERC Starting Grant soll stabile Expression von Genen erklären helfen
Die Biophysikerin Edda Schulz vom Max-Planck-Institut für molekulare Genetik (MPIMG) in Berlin wurde bei den jährlich vergebenen ERC Starting Grants mit einer Projektförderung in Höhe von 1,5 Millionen Euro ausgezeichnet. Die Förderprogramme des Europäischen Forschungsrates gehören zu den bedeutendsten in Europa. Schulz erforscht, wie Zellen Informationen aus verschiedenen Quellen zusammenführen und daraus Entscheidungen für die Entwicklung ableiten.

Eine Mammutaufgabe: Aus einer befruchteten Eizelle muss ein gesamter Organismus mit Millionen unterschiedlicher Zellen entstehen. Ihr Bauplan, das Genom, ist jedoch in allen Zellen gleich. Was entscheidet also, welche Zelle zu einem Teil des Gehirns, des Herzens oder des Ohrläppchens wird – und dies auch dauerhaft bleibt?
„Einerseits muss jede Zelle dynamisch reagieren – auf Hormone, auf Umwelteinflüsse oder eine veränderte Genaktivität – andererseits soll sie ihre Identität behalten“, sagt Edda Schulz, Leiterin der Lise-Meitner-Forschungsgruppe „System-Epigenetik“ am MPIMG. Sie hat nun vom Europäischen Forschungsrat (ERC) eine Projektförderung in Millionenhöhe erhalten. Über einen Zeitraum von fünf Jahren will Schulz damit untersuchen, weshalb manche Gene über lange Zeiträume aktiv sind, während andere dauerhaft stillgelegt werden.
Stabil für ein Leben lang
Als Modell für die grundlegende Frage der Stabilisierung von Genaktivität nutzt Schulz das X-Chromosom. Es gibt zwei unterschiedliche Arten von Geschlechtschromosomen, X und Y. Die Zellen von weiblichen Säugetieren besitzen in der Regel zwei X-Chromosomen, männliche Zellen dagegen verfügen über nur ein X- und ein Y-Chromosom.
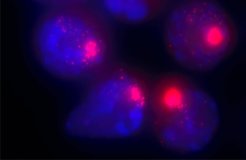
„Auch wenn Weibchen zwei davon haben, jedes Säugetier benötigt nur ein aktives X-Chromosom je Zelle“, erklärt Schulz. „In jeder weiblichen Körperzelle ist also eines der beiden Chromosomen ausgeschaltet, lebenslang stabil und unumkehrbar – welches, entscheidet der Zufall.“ Das andere Chromosom muss ebenso dauerhaft aktiv bleiben, denn auf ihm liegen zahlreiche unverzichtbare Informationen, die für Reproduktion, Gehirnentwicklung und kognitive Prozesse wie Wahrnehmung oder Lernen verantwortlich sind. Ganze fünf Prozent der bekannten menschlichen Gene sind auf dem X-Chromosom zu finden.
Das „überzählige“ X-Chromosom wird schon früh in der Entwicklung deaktiviert, wenn der Embryo aus nur einer Handvoll Zellen besteht. Dann erwacht auf einem der beiden X-Chromosomen das Xist-Gen (gesprochen: „exist“). Von diesem Gen werden fortan zahlreiche RNA-Kopien abgeschrieben, die das Chromosom einhüllen. Es folgt eine Armada epigenetischer Faktoren, die die DNA als inaktiv markieren. Als Ergebnis schrumpft das Chromosom dauerhaft zu einem winzigen Klümpchen zusammen.
Zellen können nicht würfeln oder zählen
Doch wie bestimmt die Zelle, welches der beiden X-Chromosomen in den Ruhezustand geht? Woher weiß sie, dass es bei männlichen Zellen weiterhin aktiv bleiben soll?
„Zellen können weder würfeln noch zählen“, sagt die Wissenschaftlerin. „Die Natur nutzt stattdessen biochemische und molekulare Schaltkreise.“ Diese bestehen aus Genen, aber auch RNA- und Eiweiß-Molekülen, die an Strukturen der Zelle andocken können.
„Die X-chromosomale Inaktivierung ist ein sehr komplexer Prozess, der vom Zeitpunkt der Entwicklung und vom biologischen Geschlecht der Zelle abhängig ist“, sagt Schulz. Damit er gelingt, muss die Zelle Informationen aus ihrer unmittelbaren Umgebung, aus dem eigenen Genom und dem zweiten X-Chromosom zusammengeführen und miteinander verrechnen.
Zelluläre Signale zusammengeführt – global und lokal
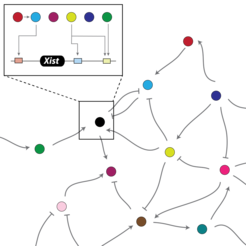
Grundsätzlich muss in jeder Zelle, egal ob männlich oder weiblich, ein X-Chromosom aktiv bleiben. Das Gen Xist, das für die X-Inaktivierung verantwortlich ist, muss im Ausgangszustand also zunächst selber inaktiviert sein. Sind jedoch zwei X-Chromosomen in der Zelle vorhanden, soll Xist eines davon ruhigstellen. Dafür sorgen molekulare Schalter in der unmittelbaren Umgebung des Xist-Gens, die ihren Effekt nur lokal auf jenem Chromosom entfalten, auf dem sie sich selbst befinden. Diese Schalter werden von ebenfalls auf dem X-Chromosom lokalisierten Faktoren bedient, die ihre Wirkung jedoch auch an Genen entfalten, die nicht auf dem eigenen, sondern auf anderen Chromosomen liegen.
Befindet sich nur ein X-Chromosom in einer Zelle, dessen Inaktivierung verhindert werden muss, darf Xist also nicht abgelesen werden. Gibt es jedoch mehr X-Chromosomen, kann Xist seine Arbeit aufnehmen und die Kaskade der Inaktivierung läuft an. Eine Reihe weiterer lokaler Schalter verkompliziert dieses Wechselspiel der Faktoren weiter.
Das Netzwerk der molekularen Schaltungen verstehen
„Wir wollen herausfinden, welche Faktoren am Geschehen beteiligt sind und wie und in welchem Maße sie zusammenarbeiten“, sagt Schulz. Das Netzwerk, das Gene, regulatorische RNAs und andere Faktoren untereinander knüpfen, will sie mit ihrem Team als mathematisches Modell im Computer nachbilden. Doch zunächst müssen die Forschenden alle daran beteiligten und zum Teil noch unbekannten Faktoren identifizieren.
Als experimentelles System dienen embryonale Stammzellen von Mäusen in der Zellkultur. Mit CRISPR-Cas9 wollen Schulz und ihr Team gezielt DNA-Abschnitte manipulieren und die Folgen durch Sequenzierung der gesamten RNA jeder einzelnen Zelle nachverfolgen. Da die RNA durch das Ablesen der Gene entsteht, spiegelt diese Analyse die Aktivität der jeweiligen Erbgutabschnitte wider.
Diese Herangehensweise ermöglicht es, zelluläre Prozesse quantitativ zu betrachten. Denn wie bei der Bestimmung der Anzahl der X-Chromosomen werden einige Abläufe offenbar erst angestoßen, sobald sich genügend Faktoren zusammenfinden, sagt Schulz. „Es müssen manchmal erst viele anschieben, damit der Stein ins Rollen kommt.“
Schulz will daher nicht nur Mechanismen rekonstruieren, also die Abfolge von Ereignissen in der Zelle herausfinden, sondern diese auch quantifizieren. Sie ist überzeugt, dass viele regulatorische Funktionen auch durch die Raten von Aufbau- und Abbauprozessen bestimmt bzw. erst nach Erreichen bestimmter Schwellenwerte angestoßen werden.
Ein beispielhafter Ausschnitt aus dem Gesamtbild
Verglichen mit den Wimmelbild, das das Geschehen in einer Zelle oder gar im gesamten Organismus darstellt, ist das Wirken des Xist-Gens nur ein sehr kleiner Ausschnitt. Doch weil die Inaktivierung robust und unabhängig vom restlichen Geschehen im Körper immer funktionieren muss, ist sie vergleichsweise einfach zu studieren. Gleichzeitig nutzt der Prozess den allgemeinen molekularen Werkzeugkasten der Zelle und kann daher beispielhaft für ähnliche Vorgänge im Genom betrachtet werden.
„Es ist unser Ziel, Genregulation über mehrere Ebenen der Komplexität zu verstehen,“ sagt die Wissenschaftlerin. Mit der zusätzlichen Förderung durch den ERC hat sie am MPIMG dafür die idealen Voraussetzungen.

Zur Person
Nach der Promotion als Biophysikerin am Deutschen Rheumaforschungszentrum und der Humboldt-Universität zu Berlin gewann Edda Schulz 2010 eines der begehrten Langzeit-Stipendien des Human Frontiers Science Program und ging als Postdoktorandin in die Gruppe von Edith Heard am Institut Curie in Paris. 2014 kam sie zum Aufbau einer Max-Planck-Forschungsgruppe an das MPIMG, wo sie inzwischen ein zehnköpfiges Team leitet. Zuletzt konnte Schulz sich eine Lise-Meitner-Förderung der Max-Planck-Gesellschaft sichern. Die Förderungen des Europäischen Forschungsrates gehören zu den bedeutendsten Förderprogrammen in Europa.
Über den Europäischen Forschungsrat
Der Europäische Forschungsrat (ERC), 2007 von der Europäischen Union ins Leben gerufen, ist die führende europäische Förderorganisation für Spitzenforschung. Jedes Jahr selektiert und finanziert er die besten und kreativsten Forschenden jeglicher Nationalität und jeden Alters, die Projekte in Europa durchführen. Der ERC bietet vier wesentliche Förderprogramme an: Starting, Consolidator, Advanced und Synergy Grants. Das erklärte Ziel des ERC ist es, Spitzenwissenschaftlerinnen und Spitzenwissenschaftler aus der ganzen Welt nach Europa zu holen















