Neue systembiologische Forschung für eine personalisierte Medizin bei Krebs
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für molekulare Genetik
Die Lösung medizinischer Herausforderungen hängt besonders von der Vorhersage des Verhaltens komplexer biologischer Netzwerke, beispielsweise aktiver Netzwerke in Tumor- und anderen Geweben unter bestimmten Bedingungen, wie zum Beispiel während einer Krebstherapie, ab. Bisher ist es nicht möglich, den Erfolg einer Therapie vorherzusagen. Forscher sequenzieren daher das Genom einzelner Krebspatienten sowie das Genom und Transkriptom ihres Tumors als Basis für ein Computermodell eines virtuellen Patienten, um Wirkung und Nebenwirkungen von Therapien individuell vorhersagen zu können.
Konzept für eine personalisierte und individualisierte Medizin
Ein Großteil der Forschung in der Abteilung Analyse des Vertebratengenoms konzentriert sich auf Vorhersagen über das Verhalten komplexer biologischer Systeme durch eine Kombination von Technologien aus der Genetik, Genomik, Bioinformatik und Systembiologie. Diese Kombination – eine der Anwendungen in der Systemmedizin - beruht auf einem einfachen Grundprinzip: das Leben ist in gewissem Sinne ein Rechenprozess. Der Organismus berechnet sich aus seinem Genom und seiner Umwelt. Wird zum Beispiel ein Krebspatient mit einem spezifischen Arzneimittel behandelt, versuchen wir, diesen Rechenvorgang im Tumor zu beeinflussen, um das Tumorwachstum zu verhindern oder die Tumorzellen in den programmierten Zelltod (Apoptose) zu bringen, möglichst mit minimalen Auswirkungen auf die anderen, gesunden Körperzellen des Patienten. Leider ist das Resultat einer solchen Behandlung - die Wirkung und die Nebenwirkungen eines Krebsmedikamentes – für jeden einzelnen, individuellen Patienten nur schwer vorauszusehen. Nur ungefähr ein Viertel der Patienten, die mit gezielt wirkenden Medikamenten, den sogenannten targeted drugs, behandelt werden, reagieren positiv auf die Behandlung, während sich der Zustand bei rund drei Vierteln der Patienten durch die Behandlung noch weiter verschlechtert. Man gibt also in diesen Fällen zum Teil sehr hohe Beträge für Medikamente und Therapien aus, die am Ende dem Patienten mehr schaden als nützen. Solche selektiven Reaktionen auf spezifische Medikamente sind am stärksten in der Onkologie ausgeprägt, letztlich treten sie aber bei Therapien fast aller Krankheiten auf. Im Durchschnitt helfen Medikamente bei weniger als der Hälfte der Patienten, bei denen sie angewendet werden.
Der selektive Therapieerfolg beruht auf individuellen Unterschieden zwischen sich ähnlich darstellenden Krankheiten bei sich ähnlich darstellenden Menschen – jeder mit verschiedenem Genom, mit verschiedenem Verhalten und verschiedensten Umwelteinflüssen ausgesetzt. Das Verhalten hochkomplexer biologischer Systeme kann beispielsweise statistisch vorausgesagt werden, eine Strategie, die wir im Moment in der Medizin ausschließlich verwenden. In den meisten anderen Bereichen, bei denen das Verhalten komplexer Systeme vorausgesagt werden soll, verfolgen wir aber eine andere Strategie, nämlich die der Modellierung. So beruhen zum Beispiel moderne Wettervorhersagen nicht auf statistischen Korrelationen, sondern auf detaillierten Modellen des Wettergeschehens, die auf Basis von Millionen Datenpunkten in Großrechnern die Wetterentstehung im Detail modellieren. Wir verfolgen eine vergleichbare Strategie. Statt zu versuchen, die Therapie ausschließlich auf der Basis von klinischen Prüfungen an großen, oft heterogenen Patientengruppen auszuwählen, wird versucht, jeden einzelnen Patienten auf der Basis von detaillierten molekularen Untersuchungen im Computer zu modellieren. Analog zur Verwendung virtueller Crash-Tests bei der Entwicklung neuer Autotypen können dann an diesem Computermodell, dem virtuellen Patienten, Wirkung und Nebenwirkungen aller möglichen Therapien und Therapiekombinationen ohne Schaden für den Patienten und ohne hohe Kosten erprobt werden (Abb. 1).
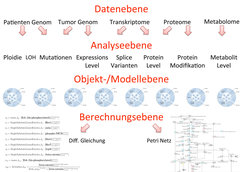
Abb 1: Konzept für eine personalisierte Medizin. Die Integration verschiedener biomedizinischer Informationsebenen bildet die Grundlage für detaillierte Computermodelle eines einzelnen Patienten zur Vorhersage von Therapiestrategien in der Klinik.
Systemmedizinische Ansätze für neue Krebstherapien
Um systemmedizinische Ansätze für neue Krebstherapien zu testen, wird im Moment gemeinsam mit der Abteilung Entwicklungsgenetik am Max-Planck-Institut für molekulare Genetik, dem Comprehensive Cancer Center der Charité (CCCC) und der Firma Experimental Pharmacology Oncology Berlin-Buch GmbH ein durch das Bundesministerium für Bildung und Forschung (BMBF) gefördertes Pilotprojekt „Tumor REsearch And Treatment – 20 Patient Pilot (TREAT20)” durchgeführt (Abb. 2). Ziel des Projekts ist es, neue Technologien der molekularen Charakterisierung und der Systembiologie direkt für die klinische Versorgung nutzbar zu machen. Entsprechend wurden 20 metastasierte Melanompatienten, die auf die Standardtherapie nicht ansprachen, ausgewählt, analysiert und soweit wie möglich auf Basis der Analyse- und Modellierungsdaten therapiert.
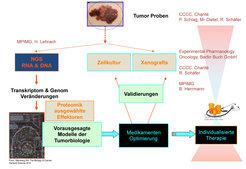
Um die Modellierung durchführen zu können, werden Genom und Transkriptom des Tumors sowie das Genom des Patienten sequenziert. Nach entsprechender Auswertung werden die Daten verwendet, um Eigenschaften und Konzentrationen dieser Objekte mithilfe von PyBioS zu bestimmen. PyBioS ist ein objektorientiertes Modellierungssystem, das zu diesem Zweck in der Abteilung entwickelt wurde. Die Interaktion der Objekte bildet dann die biologischen Netzwerke nach. Medikamente sind ebenfalls Objekte, die mit entsprechenden Dissoziationskonstanten an entsprechende Targetproteine binden und inaktive Komplexe bilden. Um aus diesen Netzwerken Voraussagen abzuleiten, wäre es notwendig, bestimmte Parameter der Reaktionen, die von diesen Objekten durchgeführt werden, zu kennen. Diese Voraussetzung kann in der Realität aber leider nur schwer oder gar nicht erfüllt werden. Wir verwenden daher zur Analyse der Netzwerke ein sogenanntes Monte Carlo-Verfahren, das seinen Namen in der Tat absichtlich nach dem berühmten Spielcasino dieser Stadt erhalten hat. Bei diesem Verfahren werden nämlich mögliche Parameter, wie in einem Spielcasino, zufällig gewürfelt und dann die Resultate vieler verschiedener Modellierungen, die mit Hilfe der zufällig gewürfelten Parameter durchgeführt wurden, verglichen.
Um die Modelle zu verbessern, aber auch um den Bereich, in dem die (unbekannten) Parameter liegen könnten, besser zu bestimmen, führen wir detaillierte Untersuchungen molekularer Veränderungen der Tumore in sogenannten Xenograftmodellen durch. Dafür werden Teile des aus dem Patienten entfernten Tumors in besonderen Mausstämmen zum Wachstum gebracht und die Mäuse anschließend mit verschiedenen Medikamenten behandelt. Behandelte und unbehandelte Xenografts werden durch Analyse des Genoms, des Transkriptoms und gegebenenfalls des Proteoms charakterisiert. Durch derartig detaillierte Untersuchungen hoffen wir, im Laufe der Zeit immer genauere Tumormodelle erstellen zu können, um so immer bessere Voraussagen von Wirkungen und Nebenwirkungen aller gangbarer Therapien für jeden Patienten zu ermöglichen.
Das beschriebene Konzept der Datenerzeugung und Integration für einen virtuellen Patienten wurde in den Abbildungen 1 und 2 schematisch dargestellt und erläutert. Das Ergebnis der "Berechnung" im Tumor und den anderen Geweben des einzelnen Patienten sowie die Vorhersage der Wirkungen und Nebenwirkungen von maßgeschneiderten Therapien sind notwendige Voraussetzungen für die Entwicklung einer echten personalisierten Medizin. Basierend auf den entsprechenden Expressions- und Mutationsdaten werden für die Patienten spezifische Krebsmodelle erstellt (Abb. 3). Dazu mussten zunächst verschiedene neu identifizierte Mutationen, zum Beispiel eine NF1-ROS1-Fusion in einem der Patienten, in das generische Krebsmodell integriert werden. Anhand der erweiterten und anschließend personalisierten Modelle wurden die Effekte der sich in der Medikamentendatenbank befindlichen Arzneien - teilweise inklusive noch nicht zugelassener Wirkstoffe - simuliert, um die für einen Patienten optimale Therapie zu identifizieren.
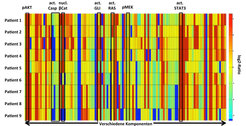
Abb. 3: Heatmap-Darstellung wichtiger Komponenten eines Modells bezüglich Genexpressionsprofilen und Mutationsmustern von Tumoren im Vergleich zu Melanozyten (log2-Ratios). Dargestellt sind die Daten von vier Patienten mit kutanen Melanomen (Patient 1-4) und fünf Patienten mit Aderhautmelanomen (malignes uveales Melanom; Patient 5-9). Das Modell sagt die Erhöhung des nuklearen beta-Catenins (rot) in Tumoren von Patient 1, 2, 3, 4, 5, 7 und 8 sowie eine erhöhte Aktivität von STAT3 und pAKT, das die Signalwege von Wnt, PI3K oder STAT3 aktiviert, bei allen Patienten voraus. Die prognostizierte Herunterregulation (blau) des aktiven Caspase-Spiegels bei den Patienten 2, 3, 4, 7, 8 und 9 zeigt, dass die Apoptose-Aktivität beeinträchtigt ist.
In schon naher Zukunft werden die Ergebnisse derart optimierter Therapien schon erste Erfolge nicht nur in der Bekämpfung von Tumoren, sondern auch was den im Vergleich zu Chemo- oder Strahlentherapien milderen Genesungs- und Therapieverlauf der Krebspatienten angeht, zeigen.


